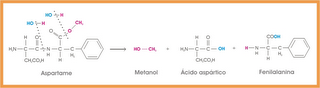
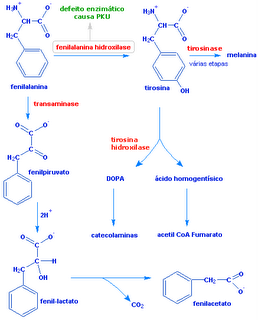
68) (UNESP-2015) Alguns historiadores
da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro
Elementos.Segundo essa teoria, a constituição de tudo o que existe
no mundo e sua transformação se dariam
a partir dequatro elementos básicos: fogo, ar, água e terra. Hoje,a química tem
outra definição para elemento: o conjunto de átomos que possuem o mesmo número
atômico. Portanto, definir a água como elemento está quimicamente incorreto,
porque trata-se de
(A) uma mistura de três elementos.
(B) uma substância simples com dois
elementos.
(C) uma substância composta com três
elementos.
(D) uma mistura de dois elementos.
(E) uma substância composta com
dois elementos.
RESOLUÇÃO:
Água
- Conjunto de moléculas iguais = substância
- Molécula formada por elementos diferentes = composta
- Formada pelos elementos = H e O (dois elementos)
RESP:E
69) (UNESP-2015) Uma das substâncias
aglutinadoras que pode ser utilizada para a nucleação artificial de nuvens é o
sal iodeto de prata, de fórmula AgI. Utilizando os dados fornecidos na Classificação
Periódica dos Elementos, é correto afirmar que o cátion e o ânion do iodeto de
prata possuem, respectivamente,
(A) 46 elétrons e 54
elétrons.
(B) 48 elétrons e 53 prótons.
(C) 46 prótons e 54 elétrons.
(D) 47 elétrons e 53 elétrons.
(E) 47 prótons e 52 elétrons.
RESOLUÇÃO:
Consultando a tabela periódica
Ag - Z=47 e I =53
No AgI
- O Ag é um cátion monovalente (+1), logo, o Ag perde 1 elétron = 46 elétrons
- O I é um ânion monovalente (-1), logo, o I ganha 1 elétron = 54 elétrons
RESP:A
70) (UNESP-2015) Além do iodeto de
prata, outras substâncias podem ser utilizadas como agentes aglutinadores para
a formação de gotas de água, tais como o cloreto de sódio, o gás
carbônico e a própria água.
Considerando o tipo de força interatômica que mantém unidas as espécies de cada
agente aglutinador, é correto classificar como substância molecular:
(A) o gás carbônico e o iodeto de
prata.
(B) apenas o gás carbônico.
(C) o gás carbônico e a
água.
(D) apenas a água.
(E) a água e o cloreto de sódio.
RESOLUÇÃO:
Substância molecular é aquela onde as moléculas apresentam, apenas, ligações covalentes.
- Ligação covalente
Ocorre entre: ametal e ametal/ ametal e hidrogênio/ hidrogênio e hidrogênio (casos mais comuns)
No dióxido de carbono: carbono é ametal/oxigênio é ametal
Na água: hidrogênio/oxigênio é ametal
RESP:C
71) (UNESP-2015) Para a produção de chuva artificial, um avião adaptado pulveriza
gotículas de água no interior das nuvens. As gotículas pulverizadas servem de
pontos de nucleação do vapor de água contido nas nuvens, aumentando seu volume
e massa, até formarem gotas maiores que, em condições
meteorológicas favoráveis, podem se precipitar sob a forma de chuva. Segundo
dados da empresa ModClima, dependendo das condições meteorológicas, com 1 L de
água lançada em determinada
nuvem é possível produzir o volume equivalente a 50 caminhões-pipa de água
precipitada na forma de chuva. Sabendo que um caminhão-pipa tem capacidade de10 m3 , a quantidade
de chuva formada a partir de 300 L de água lançada e a força intermolecular
envolvida na
formação das gotas de chuva são, respectivamente,
(A) 150
mil litros e ligação de hidrogênio.
(B) 150
litros e ligação de hidrogênio.
(C) 150
milhões de litros e dipolo induzido.
(D) 150 milhões de litros e ligação de hidrogênio.
(E)
150 mil litros e dipolo induzido
RESOLUÇÃO:
Calculando o nº de caminhões:
1L água lançada ---------------- 50 caminhões-pipa
300L água lançada --------------- X
X=15000 caminhôes-pipa
Calculando o volume de chuva
1 caminhão-pipa --------------------- 10000L água (10 metros cúbicos)
15000 caminhões-pipa --------------- X
X=150000000L água
Tipo de força intermolecular na água é ponte de hidrogênio, pois, é uma molécula polar com ligação H-O.
RESP:D
72) (UNESP-2015) De modo geral, em
sistemas aquáticos a decomposição de matéria orgânica de origem biológica, na
presença de oxigênio, se dá por meio de um processo chamado degradação aeróbica.
As equações representam reações genéricas envolvidas na degradação aeróbica, em
que “MO” = matéria orgânica contendo nitrogênio e enxofre.
Analisando as equações apresentadas, é correto
afirmar que no processo de degradação aeróbica ocorrem reações de
(A) decomposição, em que o oxigênio não
sofre alteração em seu número de oxidação.
(B) oxirredução, em que o oxigênio
atua como agente redutor.
(C) decomposição, em que o oxigênio
perde elétrons.
(D) oxirredução, em que o oxigênio
sofre oxidação.
(E) oxirredução, em que
o oxigênio atua como agente oxidante.
RESOLUÇÃO:
Nas duas equações ocorre oxidação e a redução; em ambos os casos o oxigênio sofre redução (seu NOX passa de zero para -2), portanto, é agente oxidante.
RESP:E
73) (UNESP-2015) A quantidade de
oxigênio necessária para degradar biologicamente a matéria orgânica presente na
água é expressa pela Demanda Bioquímica de Oxigênio (DBO). Sabendo que um dos
parâmetros analíticos de monitoramento da qualidade da água potável envolve a
medida da quantidade de oxigênio nela dissolvida, a presença de grande
quantidade
de matéria orgânica de origem
biológica em decomposição no fundo de determinado reservatório irá promover
(A) a diminuição da DBO e a diminuição
da quantidade de oxigênio dissolvido.
(B) o aumento da DBO e a
diminuição da qualidade da água.
(C) a diminuição da DBO e a diminuição
da qualidade da água.
(D) a diminuição da DBO e o aumento da
qualidade da água.
(E) o aumento da DBO e o aumento da
quantidade de oxigênio dissolvido.
RESOLUÇÃO:
DBO - é a massa de oxigênio para oxidar a matéria orgânica encontrada em 1L de água.
Quanto maior a quantidade de matéria orgânica, maior o consumo de oxigênio, maior a DBO, menor a qualidade da água.
RESP:B
74) (UNESP-2015) degradação anaeróbica
de matéria orgânica contendo enxofre pode levar à formação de substâncias com
odores altamente desagradáveis. Dentre essas substâncias
estão o gás sulfídrico (H2S)
e as mercaptanas, como a pentamercaptana (1-pentanotiol).
Assinale a alternativa que apresenta
corretamente a geometria molecular do gás sulfídrico e a fórmula molecular o
1-pentanotiol.
(A) Angular e C5H4S.
(B) Linear e CH4S.
(C) Angular e CH4S.
(D) Angular e C5H12S.
(E) Tetraédrica e C5H12S.
RESOLUÇÃO:
- O ácido sulfídrico é uma molécula triatômica com pares de elétrons não ligantes no átomo central, logo, a sua geometria é ANGULAR.
- O 1-pentanotiol apresenta fórmula molecular com 5 carbonos, 12 hidrogênios e 1 enxofre.
RESP:D